Der Bauplan der Materie – auf der Suche nach dem Higgs
Schon die antiken Griechen waren seit der Lehre des Unteilbaren, die auf Demokrit
(460-371 v. Chr.) zurĂŒckgeht, davon ĂŒberzeugt, dass die uns umgebende materielle Welt sich auf etwas Kleinstes, nicht weiter Teilbares reduzieren lieĂe.
Die Idee vom Unteilbaren (âatomosâ) war letztlich das Ergebnis von eher philosophischen Ăberlegungen, denen allerdings auch experimentelle Versuche vorangingen. 450 v. Chr. fĂŒhrte der griechische Philosoph Empedokles das erste historisch verbĂŒrgte Experiment zum Nachweis von Luft durch. Das schon zu diesen Zeiten seit Jahrhunderten bekannte Haushaltsutensil, die Klepsydra, diente zum Sammeln von Wasser, indem man die Klepsydra ins Wasser taucht, sie volllaufen lieĂ und dann das rohrartige Ende mit einem Finger verschloss.

Das Wasser wurde so daran gehindert auszulaufen. Aber welche Rolle spielte dabei die Luft? Empedokles Schlussfolgerung war zunĂ€chst: Es existiert etwas, was wir als Luft bezeichnen wĂŒrden. Die nĂ€chste Folgerung war die: Wenn Luft existiert, so mĂŒsste dieses âElementâ aus etwas Kleinstem, Unteilbarem bestehen.
Denn wÀre Luft aus beliebig kleinen, also letztlich auch unendlich kleinen Teilen zusammengesetzt, könnte die Klepsydra so nie funktionieren.
Man könnte die Klepsydra nie so gut mit einem Finger abdichten, dass auch die unendlich kleinen Teile der Luft nicht in die Klepsydra schlĂŒpfen wĂŒrden.
Da das Abdichten des oberen Endes der Klepsydra aber funktionierte, waren die unteilbaren Teile der Luft offenbar zu groĂ, um durch die Dichtung hindurchzuschlĂŒpfen. Die Luft bestand demnach also in diesem Sinne aus Atomen.
Man hĂ€tte ein Ă€hnliches Experiment auch mit GefĂ€Ăen durchfĂŒhren können, die man auf ihre Dichtigkeit bezĂŒglich FlĂŒssigkeitsausfluss getestet hĂ€tte. Da aber die Luft âunsichtbarâ ist, glaubte Empedokles, wenn die Bestandteile der Luft schon so klein wĂ€ren, dass man sie nicht sehen könnte, dass diese dann bestimmt die besten Kandidaten wĂ€ren, auf die die Beschreibung âatomosâ passen könnte.
Diese Vorstellung von Atomen hatte, nicht zuletzt durch jahrhundertelange kirchliche Indoktrination, weit ĂŒber 2000 Jahre nahezu unverĂ€ndert Bestand.
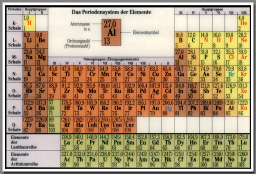
Erst 1869 gelang es Mendeleev, aus den bis dato bekannten chemischen Elementen eine Systematik zu formen, die als âPeriodensystemâ bekannt ist. Das Periodensystem weist den chemischen Elementen die unterscheidbaren Eigenschaften Masse und Ladung zu und ordnet sie danach an. Die kleinste Masseneinheit ist dabei die sog. Atommasse u, so dass die Massen aller Elemente als ein ganzzahliges Vielfaches von u benannt werden.
Ebenso wird fĂŒr jedes Element die Ordnungszahl als ganzzahliges Vielfaches von 1 benannt.
Die Tatsache, dass sich alle bekannten Elemente derart in ein Schema einordnen lieĂen, deutete daraufhin, dass die Elemente eine Unterstruktur besitzen bzw. dass sich die Elemente offenbar aus dem Vielfachen von kleinsten Teilen âkonstruierenâ lassen.
Zu Mendeleevs Zeit waren viele der heute bekannten chemischen Elemente noch gar nicht entdeckt worden. Das Periodensystem wies dort jeweils eine LĂŒcke auf, so dass vorhergesagt werden konnte, dass dann â vorausgesetzt das Periodensystem ist richtig – in der Natur ein chemisches Element existieren musste, welches genau in diese LĂŒcke passt.
Die Schlussfolgerung war, chemische Elemente setzen sich aus kleineren Bausteinen, den sog. Nukleonen zusammen.